|
Naturwissenschaften Aufbau der Materie |
 |
Naturwissenschaften Weitere Informationen |
|
| Atommodelle |
 |
Das Atom
Ein Atom ist die kleinste nicht mit chemischen Mitteln weiter zerlegbare Einheit der Materie. Das Atom besteht aus einem Atomkern und eine ihn umgebende Atomhülle. Der Atomkern besteht aus positiv geladenen Protonen und ungeladenen Neutronen.
In der Atomhülle befinden sich gleich viele negative geladene Elektronen wie positiv geladene Protonen im Kern. Das Atom ist als Ganzes ungeladen.
Fast die gesamte Masse des Atoms ist im Kern vereinigt. Elektronen und Protonen sind für die chemischen und physikalischen Eigenschaften des Atoms verantwortlich.
Die elektrische Ladung e, die Elementarladung, eines Elektrons beträgt 1,602176634.10-19 C (= Coulomb).
Die Anzahl Protonen im Kern bestimmt die Kernladungszahl eines Atoms. Jede Kernladungszahl wird einem chemischen Element zugeordnet.
Ein chemisches Element (Beispiel: Gold Au, Silber Ag, Helium He usw.) der gleichen Art verfügt immer über die gleiche Anzahl Protonen.
Die Anzahl Elektronen und Neutronen kann jedoch variieren. Atome mit gleicher Protonen- bzw. Elektronenzahl, welche sich in der Neutronenzahl unterscheiden, heissen Isotope des betreffenden chemischen Elements. Die Isotope haben unterschiedliche Atommassen.
 |
| Atome des gleichen chemischen Elements, welche unterschiedliche Elektronenzahlen haben, heissen Ionen.
Es gibt negativ geladen Ionen, welche über mehr Elektronen verfügen wie das ungeladene Atom. Positiv geladene Ionen haben ein Elektronendefizit.
Metalle bilden positive geladene, Nichtmetalle negativ geladene Ionen.
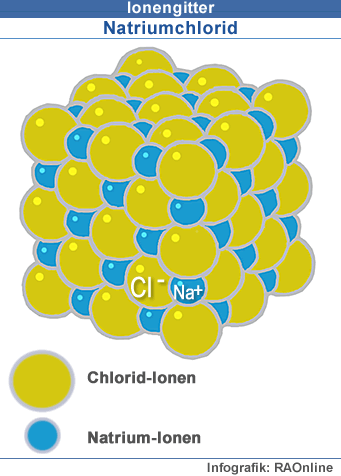
Von Ionen gehen elektrische Anziehungskräfte aus, welche räumlich wirken. Ionen bilden daher häufig Ionengitter, in welchen sich positiv geladene und negative geladene Ionen räumlich zu einem klar strukturierten Gitter gruppieren.
Die chemische Verbindung Natriumchlorid NaCl (= Kochsalz) besteht aus einem Ionengitter aus Natrium Na+- und Chlor Cl--Atomen. |
|
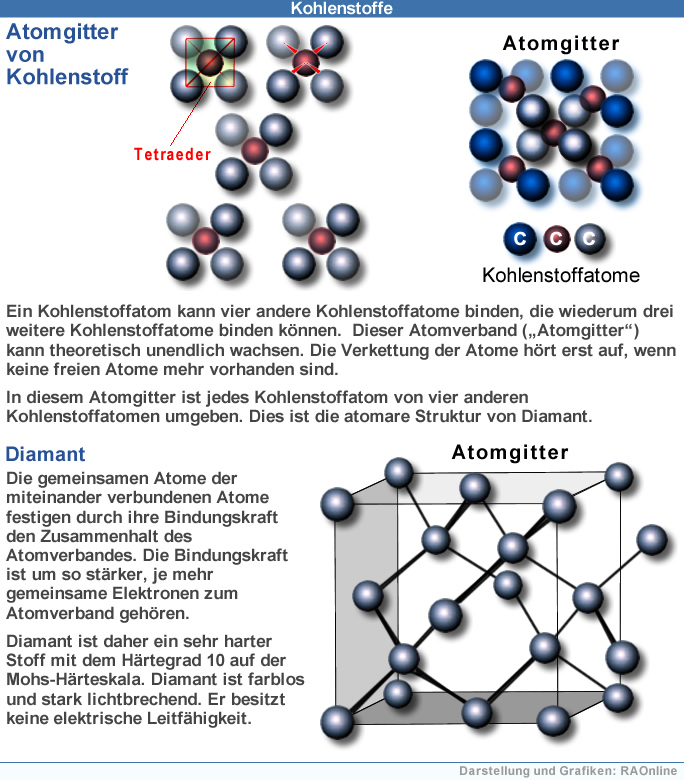
In chemischen Verbindungen vereinigen sich zwei oder mehrere Atome des gleichen chemischen Elements oder von unterschiedlichen chemischen Elementen zu Molekülen zusammen. In Molekülen gibt es oft unterschiedliche Ladungsschwerpunkte. Einen stark bipolaren Charakter hat das Wassermolekül, welches sich aus einem Sauerstoff- und zwei Wasserstoffatomen zusammensetzt.
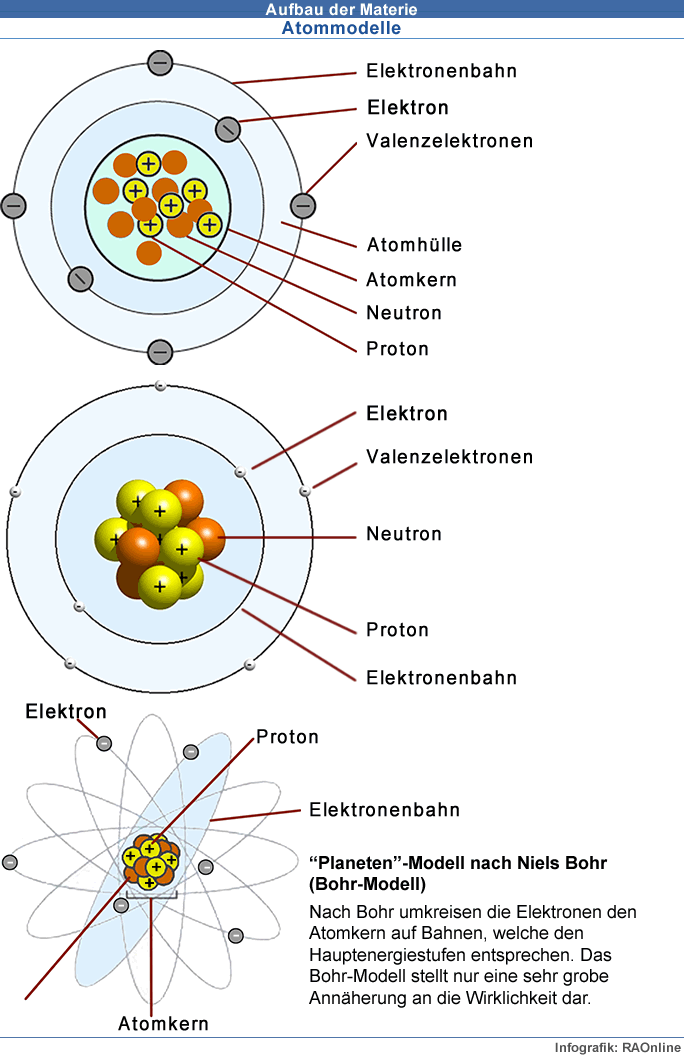
Atommodelle - Annäherungen an die Wirklichkeit
Da wir die Atome nicht sehen können, sind wir beim Denken und Entwickeln von Vorstellungen auf Modelle angewiesen. In Modellen sind allerdings die wirklichen Grössenverhältnisse nicht richtig dargestellt.
Die Verteilung der Elektronen, Protonen und Neutronen in einem Atom werden mit Hilfe von verschieden Atommodellen dargestellt. Die Atommodelle dienen dazu,Erkenntnisse über die Atomstruktur in einen theoretischen Rahmen zu stellen. Jedes einzelne Atommodell hat Vorteile und Nachteile.
Für die Visualisierung der verschiedenen Vorstellungen über die Atomstruktur wird häufig das anschauliche "Planeten"-Modell (Bohr-Modell) verwendet. Nach Bohr umkreisen die Elektronen den Atomkern auf Bahnen, welche den Hauptenergiestufen entsprechen. Das Bohr-Modell stellt nur eine sehr grobe Annäherung an die Wirklichkeit dar.
Später wurde ein Wolkenmodell der Elektronenhülle entwickelt, welche die beobachteten Erkenntnisse besser erklären und damit der Wirklichkeit näher kommen. Das Wolkenmodell geht davon aus, dass sich die Elektronen nach ganz bestimmten Gesetzmässigkeiten in negativen Ladungswolken bewegen.
Der Atomdurchmesser ist ungefähr 10'000 mal grösser als der Kerndurchmesser. Der Durchmesser eines Atoms liegt im Bereich von 10-10 m. Eine Kette von 1 cm Länge ergäbe bereits eine Anzahl von 100 Millionen Atomen.
Wissenschaftler haben heraus gefunden, dass neben dem Elektron noch weitere, kleinere Teilchen zu den Bausteinen der Materie gehören. Die 4 Teilchenarten Up-Quark, Down-Quark, Elektron und Elektron-Neutrino reichen aus, um die uns umgebende Materie zu erklären. Es gibt nach bisherigen Erkenntnissen insgesamt 12 Teilchenarten.
nach oben
| Atommodelle von Kohlenstoff und von Stickstoff |
 |
 |
 |
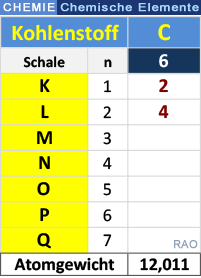
| Kohlenstoff |
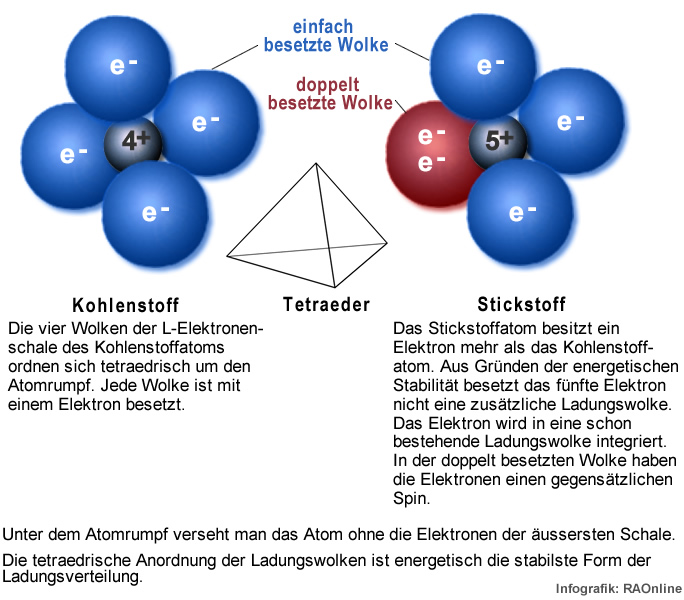
| Ein Kohlenstoff-Atom besitzt 6 Protonen und 6 Elektronen. Das Kohlenstoff-Atom kommt in zwei stabilen Varianten vor, dem 12C-Atom und dem 13C-Atom. |
|
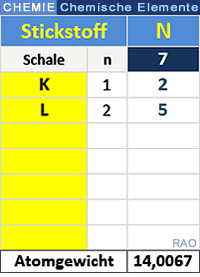
| Stickstoff |
| Ein Stickstoff-Atom besitzt 7 Protonen und 7 Elektronen. |
|
Das Wissen über den Aufbau der Materie verändert sich
Das bisher anerkannte Standardmodell der Elementarteilchen, mit welchem der Aufbau der Materie beschrieben wird, umfasst zwölf Teilchen, drei von vier Naturkräfte sowie das Higgs-Teilchen. Mit dem Standardmodell lassen sich allerdings Phänomene im Universum wie die «dunkle Materie» nicht beschreiben. Diese Schwachstellen im theoretischen Aufbau des Standardmodells deuten darauf hin, dass im Bezug auf das Modell möglicherweise Wissenslücken bestehen. Die Grundlagenforschung der Teilchenphysik verfolgt das Ziel, mit Forschungsarbeiten das fehlende Wissen zu erarbeiten.
Im Datenmaterial einer im März 2021 veröffentlichten Arbeit von Forscherinnen und Forschern mit dem Dedektor LCHb am Teilchenbeschleuniger LHC deuten sich Abweichungen vom Standardmodell an.
| Isotop (gr: isos = gleich, topos = gleicher Ort) |
Als Isotope werden Atome bezeichnet, welche die gleiche Elektronen- und Protonenzahl haben, sich aber in der Anzahl ihre Neutronen unterscheiden. Diese Atome zeigen gleiche chemische Eigenschaften. Ihre Atommassenzahlen sind jedoch unterschiedlich. Isotope stehen daher an derselben Stelle im Periodensystem der Elemente.
Viele Elemente sind Mischungen verschiedener Isotopenarten (Bsp.: Kohlenstoff mit dem bekanntesten Isotop 14C, 14 = Nukleonenzahl (Kernbausteine) = annähernd Atommassenzahl). Diese Elemente sind als Mischelemente ein Isotopengemisch. Reinelemente wie Fluor, Natrium bestehen aus nur einer Atomart. Sie enthalten keine Isotope. |
|
nach
oben
|